- TOP
- >
- 「再生医療等製品」の特許権の存続期間、延長へ
新着ニュース30件
2014年3月3日 17:00
特許庁が大筋で了承
2014年2月26日、特許庁は庁内のワーキング・グループが「再生医療等製品」の特許権について権利保護期間を通常20年のところ、最長25年間とする旨のとりまとめを行ったと発表した。「再生医療等製品」に関する企業の投資を回収しやすくし、研究開発を促す狙いだ。今後、関連する特許法施行令を改正し、11月の改正薬事法に合わせて施行される予定。改正薬事法では、従来は「医療機器」として分類されていたiPS細胞を利用した細胞シートや遺伝子導入医薬品などの「医薬品」の一部が新たな「再生医療等製品」カテゴリーに分類され、規制対象となる。これに伴い、これらを特許権の存続期間延長制度の対象とするかどうかが議論されてきた。
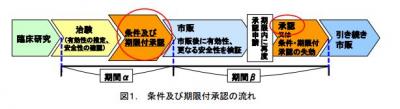
「再生医療等製品」における特許権の存続期間の延長は、治験で安全性を確認し、有効性が推定された段階で仮承認する「条件および期限付き承認」も対象となる。
(画像はニュースリリースより)
成長が期待される再生医療分野
経済産業省の「再生医療の実用化・産業に関する研究会報告書」によれば、2050年には世界市場で38兆円、国内市場で2.5兆円規模になると予想されている。手法としてはクローン作製、臓器培養、多能性幹細胞(ES細胞、iPS細胞)の利用、自己組織誘導の研究などが挙げられ、人工臓器や臓器移植といった従来の手法における困難や限界を解決するものとして期待が寄せられている。
再生医療等製品に関する特許期間の延長についてとりまとめました
http://www.meti.go.jp/press/2013/02/
-->