- TOP
- >
- 世界で初めて肝がんで起こる分岐鎖アミノ酸欠乏のメカニズムを解明
新着ニュース30件
2018年1月13日 13:00
DEPDC5遺伝子を発現誘導させると腫瘍増殖が抑制
東京医科歯科大学は1月9日、肝がんで起こるロイシンなど分岐鎖アミノ酸欠乏のメカニズムについて世界で初めて解明したことを発表した。肝がんは、肝硬変などの慢性肝障害からなることも多く、その肝硬変患者の血液において分岐鎖アミノ酸濃度が低下することが知られているが、そのメカニズムはまだ不明であった。
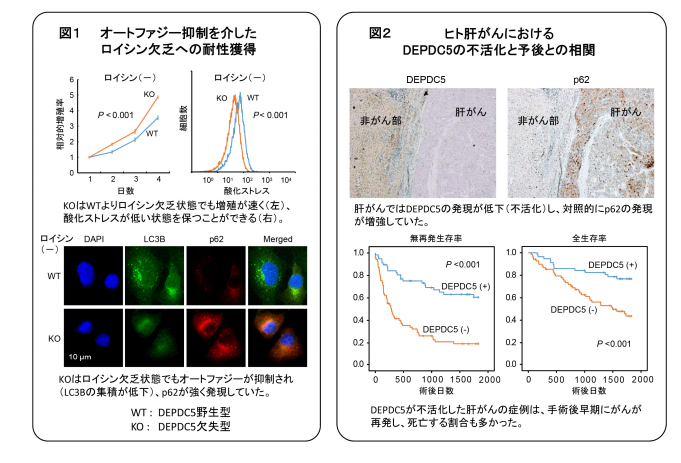
今回、東京医科歯科大学の研究チームが、ヒト肝がん細胞で、ロイシンセンサーであるDEPDC5遺伝子を、ゲノム編集法により欠失させたところ、ロイシン欠乏状態でもオートファジーとならず、分解されるはずのタンパク質の1つ「p62」が、細胞内にたまり、酸化ストレスに強い耐性を得ることが明らかとなった。
反対に、DEPDC5遺伝子を発現誘導させると、「p62」が減少し、腫瘍増殖が抑制されたことがわかったという。
また、ヒト肝がんの臨床例での解析においても、DEPDC5遺伝子が不活性化した肝がんでは、「p62」の蓄積が認められ、がんの再発、がん死亡が多いことを発見したとしている。
肝がんの新規治療薬開発に期待
これまでも、DEPDC5遺伝子は、ゲノムワイド関連解析により、C型肝炎が原因の肝がんとも関係があることが報告されており、近年、がんのアミノ酸代謝について多く発見されている。東京医科歯科大学は、慢性肝障害を合併した肝がんの新規治療薬開発につながるとして窺知している。
(画像はプレスリリースより)
東京医科歯科大学 お知らせ
http://www.tmd.ac.jp/archive-tmdu/kouhou/20180108_1.pdf
-->