- TOP
- >
- 田辺三菱製薬のALS治療薬「エダラボン」、FDAへ承認申請
新着ニュース30件
2016年6月23日 04:00
米国で約20年ぶりの新しいALS治療薬
田辺三菱製薬株式会社は、6月20日、筋萎縮性側索硬化症(ALS)における機能障がいの進行を抑制する薬剤「エダラボン」について、米国食品医薬品局(FDA)へ承認申請したことを明らかにした。FDAより承認を取得した場合、同剤は米国で約20年ぶりの新しいALS治療薬となる。
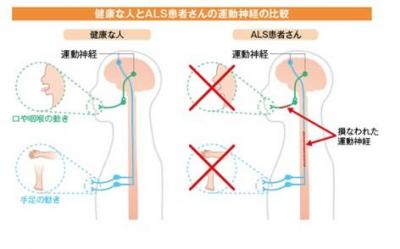
進行性の神経変性疾患、ALS
ALSは、運動神経が選択的に変性・脱落する進行性の神経変性疾患。症状は、筋萎縮と筋力低下が主体であり、初期の症状は、線維束性収縮・痙縮・手足の筋力低下などがある。病状が進行すると、上肢の機能障がい・歩行障がい・構音障がい・嚥下障がい・呼吸障がいなどが生じる。同疾患は人種や民族的背景に関連なく発症し、その確率は10万人に2人とされている。発症については様々な原因が考えられているが、未だ結論は出ていない。しかし、遺伝子研究をはじめとする基礎研究と治療薬の開発は、目覚ましい進展を見せている。
日本国内におけるALS患者の治療に貢献
「エダラボン」は、田辺三菱製薬が創製したフリーラジカル消去剤。ALSの病態で上昇するフリーラジカルを消去し、無害化する作用を持つと考えられている。同社は日本にて同剤の臨床試験を実施し、2015年6月には「ALSにおける機能障害の進行抑制」についての治療薬として日本で承認を取得。約1500名の日本国内におけるALS患者の治療に貢献してきた。今回の米国FDAへの承認申請は、日本で行った臨床試験のデータを基にして行われている。田辺三菱製薬は、一日も早く米国のALS患者に同剤を届けることができるよう尽力するという。
(画像はプレスリリースより)
日本発のALS治療薬(エダラボン)を米国FDAへ承認申請 - 田辺三菱製薬株式会社
http://www.mt-pharma.co.jp/shared/show
-->