- TOP
- >
- 分子標的薬ザーコリのコンパニオン診断薬 FDA承認取得
新着ニュース30件
2015年6月28日 23:00
ザーコリ適応の肺がん患者を識別
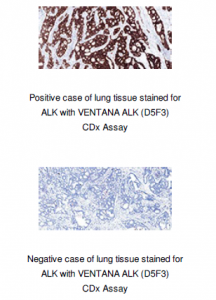
2015年6月15日、ロシュグループの一員であるベンタナ・メディカル・システムズ社(以下、ベンタナ)は、「VENTANA ALK(D5F3)CDx Assay」の承認を米食品医薬品局(FDA)より取得したことを発表した。「VENTANA ALK(D5F3)CDx Assay」はFDA承認されているファイザー社の分子標的治療薬ザーコリ(一般名:クリゾチニブ)が適応となる、患者を識別するためのコンパニオン診断薬である。
コンパニオン診断薬 (CDx)は臨床医が患者各々の特質にもとづいて効果的な治療を選択する際に、特定のバイオマーカーの存在を確認する診断薬だ。
ALK陽性の検出の重要性
肺がんは、世界において死因の第1位であり、転移性非小細胞肺がん(NSCLC)は米国において最も多くみられるタイプである。NSCLCにおける重要なバイオマーカーの1つは未分化リンパ腫キナーゼ(ALK)融合遺伝子であり、ALK融合タンパクの異常な発現に関連している。ALKのチロシン・キナーゼを阻害することが、ALK陽性患者の腫瘍縮小につながるため、ALK陽性の検出は、NSCLC患者にとって大変重要である。
ザーコリ(クリゾチニブ)は、腫瘍の重大な成長と生存の伝達経路を遮断することが示されたファースト・イン・クラスの経口ALK阻害剤で、腫瘍の縮小や成長を遅らせる。
「VENTANA ALK(D5F3)CDx Assay」
2012年にヨーロッパでCE-IVDを取得、2013年に中国国家食品薬品監督管理総局(CFDA)で承認された。今回の米国FDAのクラスIII承認により、ALK IHC検査は、世界的に広く利用可能となり、迅速な検査結果を提供することとなる。 この検査は、ザーコリ(クリゾチニブ)を用いた治療の効果が見込めるALK陽性NSCLC患者を識別するために効果的であることを実証した。
従来の蛍光in situハイブリダイゼーション(FISH)法によるALK検査では、患者が結果を受け取るまで何週間も待たなければならなかった。承認されたALK IHC検査があれば、臨床医とALK陽性患者は、数日の間にALKの状態を知り、ALK標的治療を始めるという選択肢ができる。
(画像はメディアリリースより)
ロシュ・ダイアグノスティックス株式会社 プレスリリース
http://www.roche-diagnostics.jp/news/15/06/25.html
ロシュ・ダイアグノスティックス株式会社
メディアリリース(原文)
<a href=" http://www.ventana.com/documents/media/pr_ALK_FDA.pdf " target="_blank"> http://www.ventana.com/documents/media/pr_ALK_FDA.pdf</a>
-->