- TOP
- >
- ALSの新たな病態の発見 分子標的治療の可能性へ
新着ニュース30件
2016年1月15日 20:00
病原蛋白質を分解する新たな仕組み
2016年1月12日、京都大学医学研究科・漆谷真准教授、洛和会音羽病院神経内科・内田司医師、和歌山県立医科大学・伊東秀文教授らのグループは、筋萎縮性側索硬化症の原因蛋白質の異常構造を特異的に認識して分解する仕組みを発見し、グリア細胞の病的封入体形成に関与している可能性を見出したことを発表した。背景
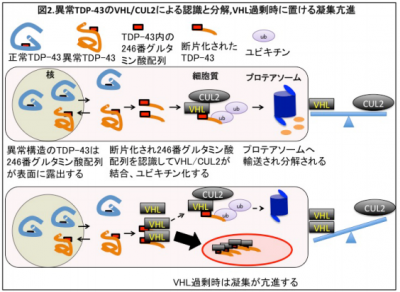
筋萎縮性側索硬化症(ALS)は随意運動に関係する神経がほぼ選択的に死滅し、全身の筋肉の萎縮と筋力低下させる神経難病である。病態はいまだに不明で、根治的な治療法も存在しない。近年、ALSの脳や脊髄の病巣で異常凝集物が蓄積する現象が知られるようになり、蓄積する異常物質の本体としてTAR DNA binding protein-43(TDP-43)という蛋白質が、主な成分であると判明したことから治療標的として注目を浴びている。
TDP-43はユビキチン化を受けていることから、ユビキチン-プロテアソーム分解系の関与が想定され、これまでTDP-43が細胞内でどのように分解されるのか、仕組みは不明だった。
研究成果
研究グループは、がん関連蛋白質von Hippel Lindau(VHL)とCullin2(CUL2)からなるユビキチンリガーゼ複合体(VHL/CUL2複合体)が、ALSで出現する病的なTDP-43と結合し、ユビキチン化とプロテアソームでの分解の促進を発見した。さらに、その仕組みの破綻が神経細胞周囲のグリア細胞であるオリゴデンドロサイトにおける病的封入体形成に関与していることを明らかにした。
オリゴデンドロサイトの機能異常はALS病態の重要な要素として注目されており、VHL/CUL2の調節異常の解明により、ALS病態の解明と治療開発に期待がもたれる。
(画像は「京都大学 研究成果」より)
京都大学 研究成果
<a href=" http://www.kyoto-u.ac.jp/ja/research/research_results/2015/documents/160111_1/01.pdf " target="_blank"> http://www.kyoto-u.ac.jp/ja/research/</a>
-->