- TOP
- >
- シナプス蛋白質PSD-95の局在を調節する酵素 同定
新着ニュース30件
2016年6月19日 17:00
脱パルミトイル化活性をもつABHD17酵素
2016年6月16日、生理学研究所生体膜研究部門・横井紀彦助教、深田祐子助教授、深田正紀教授らの研究グループは、機能があまり解明されていないセリン加水分解酵素群の中から、PSD-95に対して脱パルミトイル化活性をもった、ABHD17酵素を見出したことを発表した。背景
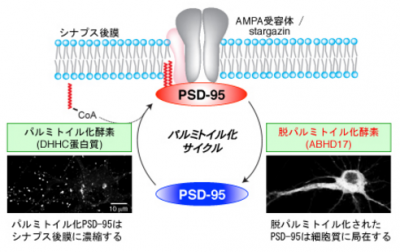
神経細胞間のつなぎ目であるシナプスが正しく機能するためには、様々な蛋白質が秩序だってシナプスに集積する必要がある。中でもPSD-95蛋白質は非常に重要で、シナプス形成やシナプス伝達を制御しており、このPSD-95がシナプス膜に局在するためには、パルミチン酸がPSD-95に付加される、パルミトイル化脂質修飾が必要となる。
今までに研究グループは、PSD-95がシナプス膜に濃縮するには、持続的にパルミトイル化と脱パルミトイル化が繰り返されるパルミトイル化サイクルが起こることを明らかにしてきた。また、PSD-95をパルミトイル化する酵素としてDHHC蛋白質を同定したが、脱パルミトイル化酵素は不明だった。
研究成果
研究グループは、PSD-95を脱パルミトイル化する活性を有するABHD17酵素を見出し、パルミトイル化された蛋白質の量比を検出することができる新しい手法(APEGS法)を開発、神経細胞におけるABHD17の効果を検討した。実際にABHD17を海馬培養神経細胞に過剰発現させることにより、パルミトイル化されたPSD-95の量が大きく減少し、神経伝達物質受容体であるAMPA受容体のシナプス局在が激減することを見出した。さらに、ABHD17酵素の発現抑制により、PSD-95の脱パルミトイル化反応が大きく遅延することがわかった。
今回の研究により、研究グループはPSD-95脱パルミトイル化酵素の同定に成功し、新たなシナプス形成およびシナプス伝達の制御因子候補を発見した。今後、動物個体レベルでの解析を進めることで、ABHD17酵素を標的とした新たなシナプス伝達修飾薬剤の開発が期待される。
(画像はプレスリリースより)
生理学研究所 プレスリリース
<a href=" http://www.nips.ac.jp/release/2016/06/psd-95.html" target="_blank"> http://www.nips.ac.jp/release/2016/06/psd-95.html</a>
-->